
На сегодняшний день более 100 фармацевтических субстанций и активных компонентов лекарственных средств отечественного производства зарегистрированы и выпускаются фармацевтическими предприятиями, и в основном, они используются для производства собственных готовых лекарственных средств (ГЛС).
В неразрывном процессе производства, этапу синтеза АФИ уделяется минимальное внимание как с точки зрения полноценного внедрения cGMP, так и с точки зрения всестороннего контроля и обеспечения качества. Эти нормы зачастую являются лишь частью основной системы менеджмента качества и надлежащей производственной практики, применяемой в области производства ГЛС.
Однако, необходимо понимать, что фармацевтическая субстанция проходит долгий и нелегкий путь от синтеза в лаборатории до масштабного производства.
Сложность пути иногда не столько связана со сложностью синтетических подходов (для решения задач тонкого органического синтеза в нашей стране достаточно компетентных специалистов), сколько с пониманием отличий лабораторного и коммерческого производства, соблюдением норм и правил надлежащей производственной практики (cGMP), поддержанием экономической эффективности производства.
На примере производства нескольких типов субстанций мы попытаемся разобраться в важности и значимости требований cGMP к производству субстанций, начиная с проектирования производства, и заканчивая их использованием в производстве ГЛС.
Классификация АФИ
Универсального классификатора фармсубстанций на сегодняшний день не существует. АФИ можно разделять, например, по химическому строению (данный тип классификации более уместен в фармакологии), или по молекулярным массам (низкомолекулярные – это вещества с точно известной структурой, гомогенные по основным физико-химическим свойствам, высокомолекулярные – напротив, гетерогенные по свойствам и по составу).
В cGMP важным понятием является риск и его оценка по влиянию АФИ на безопасность применения человеком, поэтому в данном формате, предлагается классифицировать АФИ по способу производства и источнику получения.
- Химически полученные АФИ
- АФИ, получаемые из животного сырья
- АФИ, выделяемые из растительного сырья
- Растительные экстракты в качестве АФИ
- АФИ, содержащие части растений
- АФИ, полученные путем классической ферментации
- Биотехнологические АФИ, полученные путем экспрессии в штаммахпродуцентах
Выделим основные стадии производства и уровень контроля за производством (см. таблицу 1).
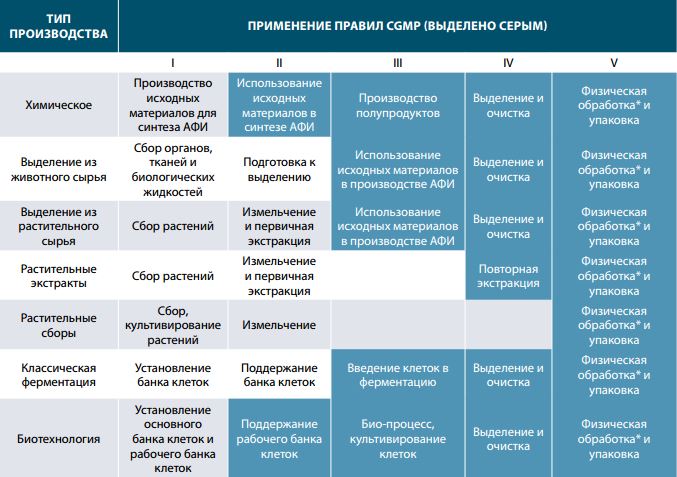
В основном, такое распределение использования норм cGMP к процессам вызвано оценкой рисков влияния данных процессов на конечный продукт.
Например, для химических соединений, используемых в качестве АФИ, требуется однородность физико-химических свойств, особенно гранулометрический состав для производства пероральных форм, соответствие полиморфной модификации, профиль примесей, присутствующих как изначально в сырье, так и вносимых в продукт в процессе синтеза. Поэтому критическими стадиями являются именно те, которые непосредственно влияют на указанные выше параметры качества – «Использование исходных материалов в синтезе АФИ» и «Производство полупродуктов» влияют на профиль примесей, «Выделение и очистка» влияет на полиморфизм и профиль примесей, а «Физическая обработка и упаковка» влияет на гранулометрический состав.
Другое влияние оказывают процессы на биотехнологические продукты. Поддержание рабочего банка клеток в нормальном состоянии гарантирует отсутствие примесных белков штамма-продуцента и холостых «балластных» белков, процесс культивирования обуславливает получение нужного белка в строгом соответствии с активной конформацией, выделение и очистка не должны приводить к денатурации, так же как физическая обработка и упаковка.
Наиболее простым в этом перечне является процесс, связанный с использованием частей растений в качестве АФИ, однако, исходя из, например, абразивных свойств некоторых компонентов растений и сопутствующих компонентов, таких как песок, требуется обратить особое внимание на детекцию металлических частиц в приготовленном и измельченном сырье, для предотвращения попадания в ГЛС. Другой пример – наличие плесневелых грибов и других микроорганизмов в измельченном сырье – может привести к серьезным анафилактическим реакциям со стороны пациентов, принимающих ГЛС.
Оборудование и помещения
Определившись с типом производства, следующий этап – выбор оборудования и определение производственной среды.
В общеупотребимых понятиях cGMP, конструкция чистых и иных помещений должна быть спроектирована и построена с учетом возможности отмывки, эксплуатации в соответствии с типом и стадией производства. В производстве субстанций нет четких правил по выбору ограждающих конструкций, их материала или других характеристик, как, впрочем, и в производстве ГЛС, однако есть ряд особенностей.
Ввиду широкого применения органических растворителей, помещения для синтеза чаще всего имеют класс пожаро- и взрывоопасности. Кроме стандартных решений конструктивного характера, препятствующих созданию высоких давлений при горении горючих растворителей, необходимо применение специально спроектированного оборудования, исключающего инициирование воспламенения смеси паров органического растворителя с воздухом. Например, применение пневматических приводов движущихся аппаратов (перемешивающие устройства) вместо электродвигателей. Особо важно вывести из пожаро- и взрывоопасной зоны все электронные системы управления, термостаты и другое оборудование, либо использовать специальные промышленные компьютерные системы в пожаро- и взрывобезопасном исполнении.
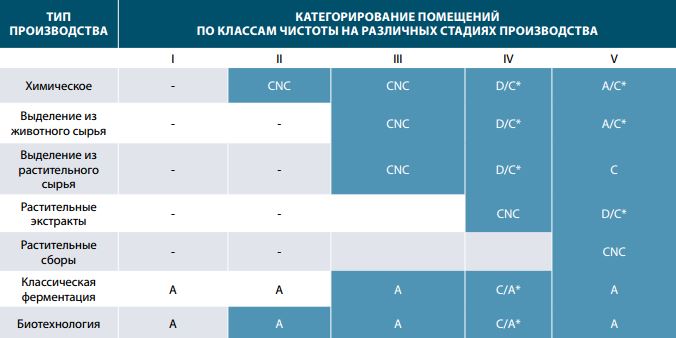
Категорирование помещений по классам чистоты также зависит от выбранного типа производства. Выбор зонирования зависит от многих параметров, наиболее важные из которых следующие:
- Микробиологические характеристики конечной субстанции;
- Влияние микроорганизмов на качественные характеристики субстанции;
- Стадии производства готовой лекарственной формы из субстанции.
Первый параметр – определяет в какой лекарственной форме будет использоваться субстанция. Для стерильно расфасованных антибиотиков, стерильность субстанции один из важнейших показателей, поэтому финальные стадии выделения и очистки, физической обработки и упаковки необходимо проводить в помещениях класса чистоты А. Для пероральных лекарственных форм, содержание микроорганизмов нормируется, но не так жестко, поэтому финальные стадии выделения и очистки, физической обработки и упаковки необходимо проводить в помещениях класса чистоты С.
Второй параметр – определяет каким образом микроорганизмы могут влиять на состав фармсубстанции. Для биологических объектов, например, терапевтических белков, наличие незначительного количества микроорганизмов стадии ферментации может необратимо изменить либо остановить процесс ферментации, загрязнить АФИ продуктами жизнедеятельности микроорганизмов. Поэтому для биопроцессов необходима строгая стерильность на всех стадиях производства и категория А для всех помещений, где имеется контакт АФИ или его полупродукта с окружающей средой.
Третий параметр – определяет будет ли АФИ претерпевать обработку при производстве ГЛС. Для субстанций, например, подвергающихся растворению при приготовлении лекарственной формы контроль частиц в помещении при их производстве является не критичным, и наоборот, если субстанция в неизменном виде фасуется или дозируется в первичную упаковку, как например, при производстве порошковых ингаляционных препаратов, то контроль частиц в воздухе рабочей зоны – критический параметр производства.
Таким образом можно резюмировать закономерности по категориям помещений для стадий по типам производства (см. таблицу 2).
Что же касается оборудования, то в этом вопросе есть все многообразие реакторных систем по типам продуктов, начиная от простейших стеклянных реакторов до многостадийных комплексов для ферментации.
Из общих требований к оборудованию – все просто: оборудование должно выполнять свои функции, должно быть пригодно для отмывки, материалы изготовления должны соответствовать требованиям для фармацевтического производства. И тут многое кроется в деталях. Выбор того или иного реактора зависит от продукта и способа его получения – это очевидно, однако, как выбрать, например, марку стали, ее способ шлифовки и т.д.?
Ответ – прост, оцените риски неблагоприятного влияния материала на АФИ. Если планируется создание производства АФИ с применением химического синтеза, естественно, для реакторов, в которых будут протекать основные реакции, с применением агрессивных сред, вопрос о нержавеющей стали не стоит. Однако на этапе очистки, перекристаллизации, фильтрации можно применять сталь, например, 304 марки, а в случае, если микробиологические параметры среды не позволяют расти микроорганизмам, то и электрополировку можно вполне оправдано заменить на шлифовку. Здесь нет четких правил и обязательств использования стали марки 316L с электрополировкой поверхности. Ферментеры же для биопроцессов, однозначно требуют использования марки 316L с электрополировкой поверхности, так как шероховатости позволят микроорганизмам закрепляться на поверхности, что делает процесс их удаления крайне трудоемким.
Контроль качества
Контроль качества на производстве АФИ мало отличается от докторской диссертации по органической, аналитической, физической и другим химиям вместе взятым.
Основное условие – чем больше знаем о процессе и продукте – тем проще управлять производством и предпринимать корректирующие действия в случае возникновения вопросов, связанных с качеством, эффективностью и безопасностью.
Постадийный контроль – главный залог выпуска качественной АФИ, при этом не важно какой тип производства. Здесь меняются только методы, параметры остаются одинаковы для всех.
Оснащение контрольно-аналитических лабораторий на производстве АФИ должно включать всевозможное оборудование для исследования характеристик веществ как химической так и биологической природы. Выделим наиболее важные характеристики, обязательные для всех субстанций:
Идентификация и подлинность
Для того, чтобы с уверенностью говорить о постоянстве процесса синтеза необходимо знать какое соединение и в какое конкретное время образуется в результате реакции.
Для этой цели можно использовать классический последовательный отбор проб и их анализ стандартными методами газовой или жидкостной хроматографии с различными видами детектирования. На этапе переноса или масштабирования технологии очень полезен будет масс-селективный детектор, позволяющий идентифицировать не только искомое соединение – продукт реакции, но и ряд побочных продуктов и интермедиатов, что крайне важно для контроля направления реакции и возможности корректировки параметров процесса для достижения оптимальных условий синтеза целевого продукта.
После отработки технологии для рутинного контроля в последнее время применяют встроенные ИК (инфракрасные) датчики, откалиброванные по основному продукту, позволяющие в режиме реального времени отслеживать полноту протекания реакции.
Контроль примесей
Чистота субстанции – основной показатель будущей эффективности и безопасности ГЛС, поэтому контроль примесей, образующихся на каждой стадии производства, является ключевой задачей постадийного контроля.
Здесь применимы как классические методы хроматографии с массселективным детектированием, так и достаточно экзотические методы, например, спектроскопия ЯМР.
Примером может служить контроль гиперсульфатированного глюкозамингликана в субстанции гепарина и его производных.
В производстве биологических субстанций, особенно моноклональных антител, большую роль в контроле правильности сборки белковых структур и соответственно биологической активности играют методы иммунобиохимии, такие как иммуноблоттинг, иммуно-ферментный анализ (ИФА), изоэлектрофокусирование и пептидное или олигосахаридное картирование
Количественное содержание действующего вещества
За терапевтический эффект ГЛС отвечает точное соответствие дозировки действующего вещества, поэтому в фармацевтических субстанциях этот показатель жестко контролируется. Обычно для химически полученных низкомолекулярных веществ этот показатель составляет 98 – 101% с учетом содержания влаги и других балластных компонентов. Для продуктов, полученных методами биотехнологии, характерна некоторая гетерогенность взаимоотношения структура – активность, поэтому количественное определение рассчитывается как мера активности биологической молекулы, например сродство к рецептору или ферментативная активность.
Диапазон методов может варьировать от простого прямого титрования, например, для веществ с выраженной кислотной либо основной функцией, до проточной цитометрии для моноклональных антител, где основным эффектом является биохимический ответ внутри живой клетки.
Резюме
Задачей данной статьи является необходимость показать всю комплексность и сложность организации производства АФИ. Стандартных решений в данной области нет, и только от полноты информации о продукте зависит успех всего предприятия. Однако, крайне важным является выбор партнера с опытом проектирования, создания и реализации комплексных проектов в различных сферах фармацевтики.
Автор материала: Константин Фроленков
Материал опубликован в журнале «Новости GMP» №1 (12) весна 2017

